Kanser Kök Hücreleri: Hematopoietik Kök Hücrelerden Lösemik Kök Hücrelere Maceralı Yolculuk
Adreas Trumpp1,2,3,* ve Simon Haas1,2,3,4,5,6
1Heidelberg Kök Hücre Teknolojisi ve Deneysel Tıp Enstitüsü (HI-STEM gGmbH), 69120 Heidelberg, Almanya
2Kök Hücre ve Kanser Bölümü, Deutsches Krebsforschungszentrum (DKFZ), 69120 Heidelberg, Almanya
3Alman Kanser Konsorsiyumu (DKTK), 69120 Heidelberg, Almanya
4Charite´ – Universitätsmedizin Berlin’de Berlin Sağlık Enstitüsü (BIH), 10117 Berlin, Almanya
5Helmholtz Derneğinde (MDC) Max-Delbrück Moleküler Tıp Merkezi, Berlin Medikal Biyoloji Sistemleri Enstitüsü (BIMSB), 10115 Berlin, Almanya
6Hematoloji, Onkoloji ve Kanser İmmünolojisi Departmanı, Charite´ – Universitätsmedizin Berlin, 10115 Berlin, Almanya
https://doi.org/10.1016/j.cell.2022.03.025
Bu yılın Gairdner Vakfı Biyomedikal Araştırma Ödülü, lösemik kök hücrelerin ve akut miyeloid lösemilerin hiyerarşik organizasyonunun keşfi için John Dick’e verilmiştir. Çalışmaları, hematopoietik maligniteler ve sert tümörler için birçok klinik etkiler ile birlikte kanser kök hücre modelinin temelini oluşturmuştur.
Birçok dokunun hücresel yenilenmesi küçük popülasyonlu, dokuya özgü yetişkin kök hücreler tarafından sağlanır. Somatik kök hücrelerin rejenaratif kapasitesine başlıca örnek yetişkin memelilerin kemik iliğinde bulunan hematopoietik kök hücrelerdir (HSC’ler). Kayda değer bir şekilde, HSC’ler kendi kendilerini yenileyebilir ve kan ve bağışıklık hücrelerinin hayat boyunca üretimi ve rejenerasyonundan sorumludurlar. Hematopoietik sistem HSC’ler en tepede olmak üzere hiyerarşik bir biçimde organize olmuştur, HSC’ler git gide daha özelleşen progenitor popülasyonları oluşturur ve bu popülasyonlar daha sonra fonksiyonel olgun kan ve bağışıklık sistemi hücrelerine dönüşür. Lösemiler gibi çeşitli hematolojik kanserler hematopoietik kök hücreleri ve progenitor hücrelerden (HSPC’ler) sağlıklı hematopoietik sistemi sonradan tekrardan programlayan ve dönüştüren genetik ve epigenetik sapmaların adım adım elde edilmesi ile türetilir. Habis dönüşüm tipik olarak HSPC’lerdeki farklılaşmayı engeller, bu da kemik iliği ve diğer hematopoietik organlarda disfonksiyonel lösemik progenitorlerin birikmesiyle sonuçlanır. Ancak, tüm lösemik hücrelerin aynı olduğu klasik düşüncenin tersine, açıkça görülmüştür ki lösemiler, tıpkı birçok diğer kanser gibi, muazzam bir miktarda tümör içi heterojenlik gösterir. En önemlisi, sağlıklı hematopoietik sistemin hiyerarşik organizasyonuna benzer bir şekilde, lösemiler hiyerarşik bir yapı sürdürür, çoğunlukla birkaç lösemik kök hücre (LSC’ler) en tepededir ve limitsiz kendi kendini yenileme kapasitesi göstererek lösemi kütlesini körükler. LSC’ler, normal HSC’ler gibi, geri döndürülebilir sessizlik haline/dormansiye girme kapasitesine sahiptir, standart kemoterapiye karşı koydukları ve hastalığın hafiflemesinden sonra hastalığı tekrardan başlatarak nüksetmeye yol açan hücresel depoyu oluşturdukları düşünülmektedir. Son 35 yılda, John Dick ve meslektaşları tarafından yapılan öncü araştırma, insan HSC’lerinin ve LSC’lerinin sırasıyla sağlıklı hematopoietik ve habis lösemik sistemlerinin hiyerarşilerini nasıl kontrol ettiği konusunda detaylı anlayışımızın önünü açmıştır. Bu bulgular, daha kapsamlı olarak formüle edilmiş kanser kök hücresi (CSC) kavramının temelini atmıştır. Bu ifade eder ki kanserler fonksiyonel olarak heterojendir, genellikle sadece birkaç kök hücre benzeri limitsiz kendini yenileme potansiyeline sahip, CSC adı verilen, görünürde başarılı bir tedavinin ardından klonal olarak rejenerasyona uğrayabilen kanser hücreleri içerir. (Reya et al., 2001) CSC kavramı, lösemiler gibi hiyerarşik şekilde organize olmuş kanserlerin ve çok sayıda katı kanserlerin anlaşılması ve tedavisi için geniş kapsamlı çıkarımlarla daha da geliştirilmiştir. (Batlle ve Clevers, 2017)
İnsan Hematopoitezini ve Lösemileri İncelemek için Model Sistemler ve Araçlar
1960’larda, James Till ve Ernest McCulloch tarafından yapılan öncü çalışma modern HSC biyoloji alanını başlatmıştır. Murin transplantasyon modellerinde bilim insanları gösterdiler ki ışınlanmış farelere kemik iliği transferi nadir, kendini yenileyebilen multipotent progenitor hücreler tarafından başlatılan çoklu olgun kan ve bağışıklık sistemi hücre nesillerinden oluşan klonal kolonilerin dalakta oluşumuyla sonuçlandı. Sonraki yıllarda murin HSC’leri, ölümcül olarak ışınlanmış farelerin yeniden yapılandırma tahlilleriyle floresan-aktifleştirilmiş hücre sınıflamasındaki (FACS) yeni olasılıklardan yararlanılarak detaylı olarak karakterize edilmiştir. Weismann, Nakauchi, Morrison ve diğerleriyle beraber Eaves gruplarının öncülüğüyle, tek bir HSC’nin transplantasyonundan sonra bile hematopoietik sistemi yeniden oluşturabilen ve koruyabilen saf fare HSC’lerini izole etmek için hücre yüzey işaretleyici profillerinin tanımlanmasına yol açtı. Ancak insan HSC’lerinin ve lösemilerdeki rollerinin incelenmesi zorlayıcı kaldı, özellikle yeterli in vivo modellerinin ve farklı HSPC popülasyonlarının ayrımına ve muhtemel saflaştırılmasını sağlayan aletlerin eksikliği sebebiyle. Bilhassa, insan bağışıklık sistemi hücrelerinin murin bağışıklık sistemi tarafından reddi ve farelerde hematopoezi desteklemek için gereken endojenez murin sitokinlerin çapraz reaktivitesinin potansiyel eksikliği, insan hematopoietik sistemi için ksenograft modellerininn gelişmesinde büyük engeller olmuştur. 1988’de John Dick ve meslektaşları bu engelleri ağır olarak immuno yetersiz farelere sağlıklı ve habis insan kemik iliği naklederek aşan ksenograft modelleri tanıttı. (Kamel-Reid ve Dick, 1988) Benzer denemeler aynı zaman diliminde Weismann ve Wilson grupları taraından da tanıtıldı. Bu ksenograftlar ilk kez insan HSC’lerinin in vivo’da çalışmasının incelenmesini sağladı, insan hastalığının patofizyolosini özetledi ve insan HSC aktivitesinin kesin numaralandırılması için bir ölçek sağladı (Bonnet ve Dick, 1997; Kamel-Reid ve Dick, 1988). Dick ve meslektaşları tarafından tanıtılan repopülasyon tahlilleri insan kök hücre aktivitesinin ölçümü alanında bir altın standart haline geldi ve diğer kanserlerle de beraber hematolojik habislikler için çeşitli ksenograf modellerin geliştirilmesine ilham vermiş, bu da in vivo preklinik ortamda ilaçların insan kanser hücrelerine etkisini değerlendirme olasılığını doğurmuştur.
Çoklu parametreli FACS’ların gelişi ile yüzey moleküllerinin tanınması ve daha duyarlı ksenograf tahlilleri ile birleştirilmiş yeni akım sitometrik geçit stratejilerinin tanıtılması, uzun dönem aşılama yapabilen bir tek insan HSC’sinin izolasyonu da dahil olmak üzere yüksek derecede saflaştırılmış insan HSP popülasyonunun tanımlanmasına ve fonsiyonel olarak karakterize edilmesine izin verdi (Doulatov et al., 2010; Notta et al., 2011). HSC’ler ve progenitorler için akım sitometrik geçitleme ve saflaştırma şemaları Dick grubu tarafından tanıtıldığı üzere çok etkileyici olmuştur ve bugüne kadar topluluktaki deneysel tasarımların temeli olarak görev yapmıştır. Diğer bölümlerde daha ayrıntılı olarak tartışacağımız gibi, beraber, yüksek duyarlı ksenograf modellerinin tanıtımı ve HSPC altpopülasyonlarının saflaştırılmasındaki yeni yaklaşımlar, sağlıklı ve habis hematopoezi detaylıca anlamamızda ve CSC modelinin tasdik edilmesinde çok önemli bir rol oynamıştır.
İnsan HSC Farklılaşmasındaki Rotaları Çözmek
300 milyardan fazla kan ve bağışıklık hücresi her gün üretilmektedir, bu küçük bir HSC havuzundan başlayan karmaşık hücresel farklılaşma programıyla düzenlenir. Son zamanlarda tek hücreli genomik teknolojilerin gelişi, böyle karmaşık biyolojik sistemlerin hücresel heterojenliğine ışık tutmuştur. Ancak, on yıllar önce, John Dick hematopoezi anlamak için insan hematopoietik sisteminde karmaşık hücresel ilişkileri tasvir etmenin önemini anlamıştı. Öncelikle, klonal barkotlama ve ksenograf transplantasyon modellerini birleştirerek, grubu çoğalma ve kendini yenilemede farklı özellikler gösteren farklı sınıf HSC’lerin hematopoietik hiyerarşide en üstte yer aldığını gösterdi. Daha sonra, John Dick uzun dönemli kendini yenileme kabiliyetli yüksek derecede potent HSC’lerin gelecekteki izolasyonunu sağlayan yeni FACS geçitleme sistemleri tanıttı ve HSC2lerin kan ve bağışıklık hücrelerine farklılaşırken geçtikleri gelişimsel farklılaşma rotalarının tasvirine ön ayak oldu (Notta et al., 2011, 2016). Yüksek derecede saflaştırılmış HSPC popülasyonlarının ve tek HSPC’lerin moleküler, hücresel ve fonksiyonel karakterizasyonu soy sınır noktalarının tanımlanmasıyla sonuçlandı ve makrofaj, dendritik hücre, lefoid, eritroid ve megakaryotik soyların soy bağlılığında temel bilgileri ortaya çıkardı (Doulatov et al., 2010; Notta et al., 2016). Bu çalışmalar insanda kan oluşumunu nasıl anladığımızı şekillendirdi, hematopoezde birçok paradigma kaymasına katkıda bulundu ve murin hematopoezinin en yeni modellerine uygun saf bir HSC soy bağlılığı modelinin kurulmasına yardım etti (Figür 1).
Lösemilerin Hücresel Kökeni Olarak Kök Hücreler
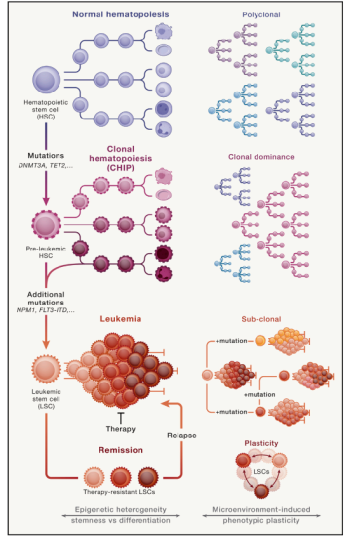
İnsan kanserlerinin hücresel kökenlerini bulmak kanser araştırmalarında en zorlayıcı ve tartışmalı konulardan biri. Farklılaşmamış lösemik hücrelerin ve HSC’lerin yüksek miktarda örtüşen özellikleri dolayısıyla, John Dick ve meslektaşları 1990’larda bir ilkel kök hücresinin ya da erken progenitor hücrenin, bağlı hale gelmiş bir hücrenin değil, muhtemelen AML’de habis transformasyonun kökenini oluşturduğunu çoktan varsaymıştı (Bonnet and Dick, 1997; Lapidot et al., 1994). Normal hematopoietik progenitor hücrelerde BCR-ABL translokasyonunun ve lösem,k olmayan kök hücrelerde AML 1-ETO transkriptlerinin belirlenmesi insan kronik miyeloid lösemisinde ve AML’de sağlıklı HSC’lerin hedef olabileceği hakkında ilk genetik kanıtı sağladı. Daha sonra, tek hücreli tahliller kullanımı ile, HSC’lerden başlayan sürücü mutasyonların sıralı eldesi, hastalarda pre-lösemik hücrelerin varlığını gösterdi (Jan et al., 2012) AML’lerin başlatıcı kökenlerini HSC’lerden aldıkları hipotezinin daha ileri kanıtı hastalığın erken safhalarında kazanılan mutasyonların (e.g. DNMT3A, TET2) hem multipotent HSC’lerde hem de T hücrelerinde yaşandığını ancak klonal evrimde daha sonra kazanılan mutasyonların sadece AML blastlarında bulunmasından (e.g. NPM1, FLT3-ITD) geldi. (Figür 1) (Slush et al., 2014) Bu, bir multpotent hücrenin, yani HSC’nin, bu durumda köken hücresi olması gerektiğini gösterdi. Şok edici bir biçimde, böylesi pre-lösemik DNMT3A mutant HSC’lerin kemoterapiden sağ çıktıkları ve sağlıklı HSC’lerle karşılaştırıldıklarında çoğalma avantajı gösterdikleri ve böylece fazladan mutasyonlarla tam olarak dönüşmüşse nüksetme kaynağı olarak görev yapabilir. (Figür 1) 2014’te pre-lösemik mutasyonların kazanılmasıyla sağlıklı HSC’lerden türeyen uzun yaşamlı, multipotent pre-lösemik kök hücre havuzunun var olması kavramı, sağlıklı donörlerden alınan on binlerce kan örneklerinde DNA sekanlaması gerçekleştirilen iki dönüm noktası çalışmadan beklenmeyen bir destek gördü. Bu analizler klonal hematopoez olgusunu ortaya çıkardı: DNMTA3A’daki veya hematolojik kanserlerde tekrar tekrar mutasyona uğrayan diğer genlerdeki mutasyonlarla işaretlenen, kayda değer sayıda sağlıklı yaşlı bireylerde meydana gelen kan hücrelerinin klonal yayılması (Köhnke ve Majeti, 2021).
Pre-lösemik HSC’ler kavramına uygun olarak, belirsiz potansiyelin klonal hematopoez [clonal hematopoiesis of indeterminate potential (CHIP)] tek bir mutasyonlu HSC tarafından meydana getirilir. Bu, hayat boyunca korunan genetik olarak eş, her hücrenin aynı mutasyonu taşıdığı kan hücre klonu başlatır (Figür 1). CHIP’in varlığı hematolojik kanserlerin ve kardiyovasküler hastalıkların gelişmesinin yüksek riski ile ilişkilidir, ikincisi potansiyel olarak makrofajlar gibi olgun mutant hücrelerin işlev bozukluğundan kaynaklanmaktadır (Köhnke ve Majeti, 2021). Topluca, bu bulgular sağlıklı insan HSC’lerinin lösemilerde köken hücre olarak oynadığı yol hakkında çok önemli kanıtlar sağlar ve pre-lösemik HSC’lerin klonal hematopoezin kaynağı ve AML ve diğer hematolojik kanserlerin öncüsü olarak belirlenmesinin klinik önemini vurgular.
Lösemilerde Kök Hücre Hiyerarşileri
Son 50 yılda, açık olmuştur ki kanser hücreleri ve doku kök hücreleri birçok ortak özellik taşır; yüksek çoğalma kapasitesi, uzun dönemli kendini yenileme potansiyeli ve kök hücreselliği yöneten yolakların aktivitesi de dahil olmak üzere. John Dick’in lösemilerde ve katı kanserlerde yeni ufuklar açan çalışması kök hücreler ve kanser arasındaki ilişkiyi anlamada önemli bir rol oynamıştır. Lösemik hücreler arasındaki hiyerarşik ilişki 1970 ve 1980 yılları boyunca çoktan anlaşılmış olsa da, John Dick’in meslektaşları Tsvee Lapipot, Dominque Bonnet ve diğerleri ile yaptığı dönüm noktası niteliğindeki çalışmaları hiyerarşik yapılı löseminin en tepesinde bulunan sözde LSC’lerin varlığına ilk direkt deneysel kanıtını sağlamıştır (Bonnet ve Dick, 1997; Lapidot et al., 1994). Bu çalışmalar gösterdi ki akut miyeloid lösemilerdeki (AML’ler) lösemik hücrelerin çoğunluğu sınırlı çoğalma ve kendini yenileme kapasitesine sahipken sağlıklı HSC’lerle immunofenotipi paylaşan ve yüksek kendini yenileme potansiyeli gösteren bir özgün, nadir popülasyon immuno yetersiz farelerde lösemiyi özellikle tekrardan başlatabilir (Bonnet ve Dick, 1997; Lapidot et al., 1994). Bu buluş bir CSC’nin ilk fonksiyonel kanıtının belirtti, bu kavram da birkaç yıl sonra Irving Weissman ve meslektaşları tarafından katı tümörlere genişletildi ve saflaştırıldı (Reya et al., 2001).
Önemli şekilde, lösemik hiyerarşinin en tepesinde bulunan LSC’lerin lösemiyi sağlıklı HSC karşılıklarına benzer olarak teşvik ettikleri düşünülür. LSC’lerin HSC’ler ile birçok özellik paylaştığı bulundu, bunlardan bazıları uzun süreli kendini yenileme kapasitesi, daha çok farklılaşmış hücreler ortaya çıkarabilme, örtüşen bir immunofenotip, geri dönebilir olarak durgun hücre döngüsü safhasına geçebilme kapasitesi ve kök hücresellik ile ilişkili gen ifade programlarını yöneten gen düzenleyici ağlardır (Bonnet and Dick, 1997; Eppert et al., 2011; Lapidot et al., 1994). Çarpıcı biçimde, farelerdeki işlevsel olarak aşılayıcı LSC alt popülasyonlarından türetilmiş kök hücrelikle ilişkili gen imzalarının yüksek ifadesi AML hastalarında kötü sonuçların güçlü bir öngörücüsü oldu (Eppert et al., 2011; Ng et al., 2016). Aslında, 17 genden oluşan, yüksek derecede prognostic olan ve tedavi cevabını tahmin eden LSC imzası türetildi (Ng et al., 2016). Bu çalışmalar sadece LSC’lerin AML’lerdeki önemimi etkileyici bir şekilde göstermekle kalmamış ama aynı zamanda lösemilerin kök hücre profillerine bağlı olarak özel olarak tedavi edilmesi gerektiğini önermiştir. Bu bulgulara göre, AML’lerin kök hücresellik özelliklerini dikkate alarak kişiselleştirilmiş tedavi seçimlerine olanak sağlamayı hedefleyen standartlaştırılmış bir laboratuvar testi geliştirilme aşamasındadır.
Figür 1. Genetik sapmaların adım adım eldesi sağlıklı HSC’leri pre-lösemik HSC’lere ve LSC’lere dönüştürür
Sağlıklı hematopoez sırasında kan ve bağışıklık hücrelerin üretimi birçok HSC’nin eş zamanlı aktivitesi tarafından yönlendirilir. Tek bir HSC’de pre-lösemik mutasyonların eldesi (e.g. DNMTA3A, TET2) çoğalma avantajıyla ve tüm soyun aynı mutasyonu kalıtmasıyla, CHIP adı verilmiş bir durum, bir HSC klonunun klonal olarak büyümesiyle sonuçlanır. Ek mutasyonlar (e.g. NPM1, FLT3-ITD) bu klondaki pre lösemik HSC/progenitorleri hakiki LSC’lere dönüştürür. LSC’ler tedaviden sonra hayatta kalabilir ve kanseri tekrardan başlatma kapasitesine sahiptir. Genetik heterojenlik (alt klonlar), epigenetik heterojenlik (alt klonlar arasındaki hiyerarşiler) ve plastisite (çevre aracılı) LSC çeşitliliğine, tedavi direncine ve nüksetmesine katkıda bulunur.
Katı Tümörlerde CSC Modeli
Kök hücrelerin kök hücresellik karakterlerinde farklı olabilecekleri ve hiyerarşik olarak organize olmuş olabilecekleri bulguları 2000 yılından beri katı tümörlerde CSC’ler bulma uğraşını canlandırdı. Her kanserin katı bir biçimde hiyerarşik olarak düzenlendiğine inanılmasa da, ksenograf sistemlerde yeniden yapılandırma tahlilleri kullanılarak bazı insan CSC’leri katı tümörlerde belirlenmiş ve karakterize edilmiştir (Kreso and Dick, 2014). 2007’de John Dick kolon kanserinde CSC’leri keşfetti ve derin bir şekilde karakterize etti, böylece bu kanserin hiyerarşik organizasyonunun gösterdi. Kanserlerin hiyerarşik organizasyonu hakkındaki bu bulgular, bugünün iyi tanınan tümörlerdeki tekli kanser hücrelerinin heterojenliği kavramını yarattı. Önemli olarak, bu heterojenlik genetik mutasyonlarla sınırlı değildir ve transkripsiyonel programlar, metabolik fenotipler, fonksiyonel özellikler ve (mikro)çevrenin etkisi gibi genetik olmayan özellikleri de içerir. Bu bağlamda, John Dick’in çalışması önerir ki tek hücrelerin kök hücresellik özellikleri ve çoğalma kapasiteleri gibi genetik olmayan özellikler klonal evrim ile kazanılmış genetik heterojenlik ile uyum içinde davranır, böylece CSC kavramını genetik evrim modelleri ile uzlaştırır (Kreso and Dick, 2014) (Figür 1).
Özellikle, her kanserin katı bir şekilde hiyerarşik olarak organize olduğuna inanılmamaktadır. Soy takibi yaklaşımları göstermektedir ki bazı tümörlerde, CSC özellikleri değiştirilemez fenotipler değildir ancak belirli bir plastisitenin temelini oluşturur (Batlle and Clevers, 2017). Böylece, CSC modelinin düzeltilmiş kavramları hücresele plastisiteyi CSC’lerin yaygın bir özelliği olarak görür. Enfeksiyon, enflamasyon ya da zehirli maddeler gibi çevresel işaretlere rejenaratif eylemler ile cevap veren normal somatik kök hücrelere benzer olarak CSC’ler tedavi baskısı da dahil olmak üzere dış uyaranlara karşı fenotiplerini ve davranışlarını adapte edebilir. Tedavi baskısına cevapların örnekleri epitelden mezenkimale dönşümü (EMT), nöroendokrin farklılaşmayı, metabolik plastisite ya da geri dönüşümlü sessizlik ve yaşlanmayı içerir. Tüm bu özellikler CSC’lerin tedavi direncine katkıda bulunur. Örneğin, BCL-2 antagonist Venetoclax özel olarak AML-LSC’leri hedefler ve CSC’leri klinik ortamlarda hedefleyebildiği gösterilen onaylı az miktarda ilaç arasındadır. Bu tedaviyle ilişkili baskıdan kaçmak için, LSC’ler metabolik plastisitelerinden faydalanabilir ve tedaviden sağ çıkmak için yağ asidi metabolizmalarını yukarı doğru regüle edebilir (Stevens et al., 2020). Dahası, tedavik ve evrimsel baskının altında, plastisitedeki bir artış CSC olmayan durumlardan CSC’ye benzer durumlara geçişle ilişkilendirilebilir, böylece kademeli geri farklılaşma yoluyla kaçış stratejilerini kolaylaştırabilir. Kök hücre plastisitesinin çok önemli bir CSC bileşeni olarak görülmesi, klinik ortamlarda CSC’lerle savaşmak için etkili stratejilerin geliştirilmesin neden zor olduğunu açıklayabilir. CSC plastisite kavramı, John Dick ve diğerleri tarafından geliştirilen kanser sistemlerinin genetik ve epigenetik heterojenliği modeline üçüncü, dinamik bir katman ekler (Figür 1)Epigenetik ilaçların uygulanması ile CSC plastisitesinin inhibisyonu ve sömürüsü ya da CSC’nin immuno-tedaviler ile eliminasyonu CSC’lerle savaşmak için ve kanser nüksetmesini önlemek için gelecek stratejilerde önemli bir bileşen olabilir.
Etki ve Sonuç
Son on yıllarda John Dick tarafından yapılan bilimsel katkılar hem büyüklük hem de çeşitlilikleri açısından önemlidir. Onun ve grubunun tarafından tanıtılan teknolojik ve kavramsal ilerlemeler çok etkili ve hematoloji ve onkoloji alanlarında birçok çığır açıcı keşif için yararlı olmuştur. Günümüzde aynı tümördeki tek kanser hücrelerinin transkripsiyonel programlar, mutasyonlar, metabolik özellikler ve fonksiyonel özellikler bakımından azımsanmayacak heterojenlik gösterdiği iyi tanınmışken John Dick tarafından yapılan çığır açıcı keşifler ve tanıtılan kavramlar tümör içi heterojenliği anlamamızda ve LSC’leri belirlememizde büyük öneme sahip olmuştur. Bu bağlamda, John Dick’in öncü çalışmaları, hiyerarşinin en tepesindeki tedaviye dirençli LSC havuzunun yok edilmesinin löseminin nüksetmesini engellemek için öneminin tam olarak nedenini gösterir. Son olarak hücresel plastisitenin, kök hücreselliğe aracılık eden, i.e. tedavik baskıya bir cevap olarak, kanser heterojenliğine bir ek dinamik katman olarak görülmesi CSC kavramını lösemiler ve katı tümörler için daha da düzeltir (Figür 1). CSC kavramı kanseri anlamamızda geniş uygulamalara sahip olmakla kalmaz, aynı zamanda gelecekte daha etkin tedavi planlarına sahiptir.
Çıkar Beyanı
Yazarlar çıkar çatışması belirtmemektedir.

